1989년 인체를 대상으로 한 최초의 암 유전자 치료를 시도했다가 실패한 지 17년 만에 암 유전자 치료의 이정표를 세웠다는 평가를 받는 이번 연구를 진두지휘한 로젠버그 박사는 암 면역학 분야의 세계적 석학이다. 그는 암 유전자 치료 외에도 다양한 면역학적 암 치료법을 개발한 바 있다.
이번에 발표된 암 유전자 치료법을 간단히 설명하면, 환자의 정상적인 면역세포를 혈액에서 분리하여 흑색종 암세포만을 특이적으로 인식하는 단백질을 생산할 수 있도록 유전자조작을 통해 변형시킨 뒤, 이를 흑색종이 여러 장기로 전이된 환자에게 혈관을 통해 주입하는 것이다. 이렇게 유전적으로 변형된 면역세포는 환자의 체내에서 전이된 암세포를 인식, 부착하여 암세포를 괴사시키는 물질을 분비함으로써 암조직을 제거하는 것으로 확인됐다.
그러나 15명의 이번 연구 대상 중 2명에게서만 효과적인 암조직 제거가 관찰되었기 때문에 아직까지는 이 유전자 치료법이 표준치료법으로 사용될 수 있는 수준은 아니다. 결론적으로 말하면, 필자는 로젠버그 박사의 이번 연구 결과를 그동안 회의적으로 인식돼왔던 암 유전자 치료에 다시 희망의 불을 당긴 계기 정도로 받아들이면 되지 않을까 생각한다.
새 의학용어 ‘인체 유전자 전달’
그동안 유전자 치료란 DNA 재조합 방법으로 정상적인 단백질을 발현할 수 있는 유전자를 환자의 세포 안에 주입시켜 유전자의 결함을 교정하거나 세포에 새로운 기능을 추가함으로써 인체 세포의 유전적 변형을 통해 유전적 결함을 예방 및 치료하는 방법으로 알려져 왔다. 하지만 지금은 유전자 치료의 개념이 확장돼 유전성 질병뿐만 아니라 HIV(인간면역결핍바이러스) 감염에 의한 에이즈 같은 후천성 획득 질병, 암, 그리고 많은 감염성 및 퇴행성 질환의 치료에도 적용될 수 있다. 나아가 인슐린 유전자의 경우처럼, 유전자에 이상이 있는 췌장세포를 교정하는 것보다는 혈관내피세포에 그 유전자를 도입시켜 발현하는 것이 당뇨병 치료에 더욱 실용적이고 효과적이라는 사실도 밝혀졌다. 또한 이종 유전자를 도입하거나 유전자 발현 및 단백질의 기능을 조절해 세포에 새로운 형질을 부여하는 방법들을 이용해서 질병을 치료하는, 즉 초기의 유전자 치료 개념이 확장된 ‘인체 유전자 전달’이라는 새로운 의학용어가 사용되기에 이르렀다.
유전자 치료를 비롯한 모든 기초의학 연구는 궁극적으로 사람의 수명을 연장시키는 동시에 죽기 전까지 신체적·정신적으로 건강한 삶을 영위토록 하는 데 목적이 있다. 지난 30년간 많은 과학자들이 결손 유전자의 교정을 통해 많은 질병의 완벽한 치료를 꿈꿔왔다. 1953년 왓슨 박사와 크릭 박사에 의해 유전 전달물질인 DNA의 구조가 밝혀진 지 50여 년, 최대 2만~3만 개로 추정되는 인간 유전자 중 이미 1만여 개 유전자의 기능이 규명된 상태다. 지난 20여 년간 분자생물학 분야의 눈부신 발전은 질병을 유전자 차원에서 연구할 수 있는 도구를 제공했으며, 새로운 차원의 진단과 약물치료를 가능하게 만들었다.
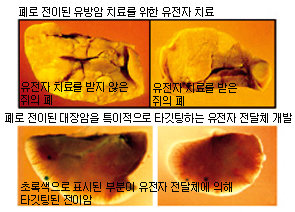
인제대 인당분자생물학연구소가 개발 중인 전이암 유전자 치료 연구
한국에선 4건 임상시험 진행
현재 많은 유전자 치료 전략들이 암을 치료하기 위해 개발, 시험 중이다. 2005년 12월까지 전 세계적으로 1000여 개의 임상 유전자 치료 프로토콜 중 약 70%가 암을 대상으로 한 것들이다. 유전자 치료가 암 치료법의 대안으로 등장하게 된 이유는 기존의 외과적 수술이나 방사선 치료 같은 국부요법의 대상이 되는 환자가 전체 환자의 3분의 1에 불과하며, 항암제나 면역치료제를 사용하는 방법도 일부 암을 제외하고는 큰 효과를 거두지 못하기 때문이다. 그러나 많은 기대와 관심 속에서 시작된 암 유전자 치료는 아직까지 그 효과에 대해 회의적인 측면이 없지 않다. 암세포에 관한 정보의 축적, 효과적이고 조직 특이적인 유전자 전달 방법의 개발 등 해결해야 할 난제가 많기 때문이다.
지금까지 공식적으로 등록된, 한국의 유전자 치료 임상시험은 모두 4건이다. 이 중 3건이 암을 대상으로 한 시험이고, 말초동맥질환 환자를 대상으로 한 1건의 임상시험이 진행됐다. 그러나 아직까지 획기적인 치료 성과나, 독자적인 기술로 시행된 유전자 치료에 관한 임상시험은 보고된 바 없다. 즉 위에서 언급한 임상시험을 포함해, 의과대학의 임상전문의들과 소수의 기초과학자들을 주축으로 한 암 및 일부 유전성 질환의 유전자 치료를 위한 전임상연구가 주를 이루고 있다. 미국 등 선진국에서 도입된 벡터나 유전자를 여과 없이 사용함으로써 이미 국외에서 수행된 내용을 반복 재현하는 수준에서 유전자 요법 관련 기술을 습득하는 기술도입 단계에 있는 것이다.
하지만 현재 국내에서도 기술도입 단계를 벗어나 독자적인 유전자 치료 기술과 경쟁력을 확보하고 산업화를 이루기 위해 유전자 치료 기초연구(벡터시스템의 개선 및 개발, 새로운 치료유전자의 탐색 및 발굴 등)에서 일부 성과를 올리고 있으며, 정부(과학기술부, 산업자원부)도 이를 가속화하기 위해 유전자 치료 연구집단을 선발해 집중 지원 중이다. 특히 과학기술부에서는 2005년부터 원천특허를 확보할 수 있는 유전자 전달 시스템과 치료유전자를 개발하고, 유전자 치료 임상까지 목표로 한 연구지원을 시작함으로써 독자적인 유전자 치료 기술 구축을 위한 프로젝트를 진행하고 있다.
유전자 치료 기술의 성공은 새로운 시장의 창출 및 차세대 성장동력 기술 확보라는 경제논리 측면에서 매우 중요하다고 본다. 그러나 그에 못지않게 중요한 것은 유전자 치료 기술의 발전을 위한 노력이 질병에 대한 인류의 도전, 나아가 질병의 고통을 해결할 수 있는 방법을 찾고자 하는 사회의 책임이라는 점이다. 물론 이러한 요구를 하기 전에 연구자와 언론은 연구결과를 화려하게 포장하거나 홍보 수단으로 사용하는 우를 범하지 말아야 할 것이다.