
얼른 감이 안 올 테니 예를 하나 들어보자. 신생아 500명 가운데 1명꼴로 발생하는 ‘비후성(肥厚性) 심근증’이라는 병이 있다. 한자로 된 병명 그대로다. 선천적으로 심장 좌심실 벽이 지나치게 두꺼운 병이다. 심장 내부 공간이 좁아지면 몸에 피를 충분히 공급하지 못한다. 아이는 호흡 곤란을 일으키고 통증을 호소하다 심하면 사망에 이른다.
비후성 심근증은 우리 몸속 23개 염색체 가운데 11번째 염색체에 존재하는 유전자(MYBPC3)의 돌연변이로 발병할 개연성이 높다. 엄마, 아빠 중 한 명이라도 돌연변이 유전자를 갖고 있으면 자식에게 50% 확률로 발병할 수 있다(우성 유전). 만약 아이가 태어나기 전 이 돌연변이 유전자를 제거할 수 있다면 어떻게 될까.
크리스퍼, 유전자 자르고 붙이고!
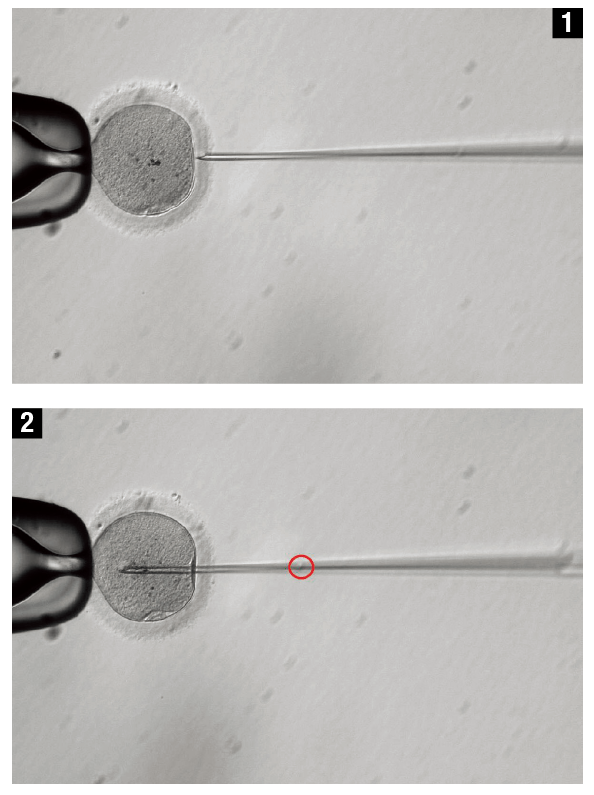
인간을 비롯한 생명체의 유전 정보가 담긴 DNA는 아데닌(A), 구아닌(G), 티민(T), 시토신(C)이라는 네 가지 분자(염기)로 구성된다. 인간 유전체 프로젝트 결과를 보면 사람은 아데닌-구아닌, 티민-시토신 등이 짝을 이룬 30억 개가량의 염기쌍으로 구성돼 있고, 그 안에 약 2만5000개의 유전자가 담겨 있다. 이 유전자의 집합이 바로 ‘유전체(Genome)’다.
그런데 유전자 약 2만5000개 가운데 단 하나에만 문제가 있어도 심각한 질환이 발생할 수 있다. 예를 들어 애초 아데닌이 들어가야 할 자리에 티민이 들어간 것만으로도 문제가 될 수 있다. 이렇게 유전자 자체가 잘못돼 발생하는 질환을 ‘유전병’이라고 부른다. 혈우병, 낭포성 섬유증, 비후성 심근증 같은 병이 이에 해당한다.
바로 이 대목에서 유전자 가위 크리스퍼의 쓰임새가 등장한다. 크리스퍼는 세 가지 일을 할 수 있는 유전체 편집 기술이다. 일단 아데닌 대신 티민이 잘못 들어간 자리를 비교적(!) 정확하게 찾을 수 있다(검색기). 또 문제를 일으킨 티민을 자를 수 있다(가위). 그리고 (정확하지 않아서 문제를 일으킬 수도 있지만) 잘라낸 티민 자리에 아데닌을 다시 써넣을 수도 있다(연필).
크리스퍼 이전에도 유전자 일부를 자르고 붙이는 유전체 편집 기술은 존재했다. 하지만 편집 대상을 찾는 능력이 형편없었다. 크리스퍼는 이전과 비교했을 때 비용이 저렴하고 시간도 절약된다. 예전에 5000달러가량(약 600만 원) 들었던 일이 크리스퍼로는 30달러(약 3만6000원) 정도면 가능하다. 또 만드는 데 1년가량 걸린 유전자 변형 생쥐를 크리스퍼는 두 달 내 세상에 선보일 수 있다.
김진수 단장 같은 과학자는 크리스퍼가 비교적 빠른 시간 안에 유전병 치료에 돌파구를 마련해줄 것으로 기대한다. 하지만 상당수 과학자는 크리스퍼가 생명 현상의 신비를 밝히는 과정에서 유용한 실험 도구임은 인정하면서도, 이 기술의 응용 가능성에 대해서는 조심스러운 태도를 보인다. 해결해야 할 문제가 한두 개가 아니기 때문이다.
글머리에서 소개한 연구에서 확인할 수 있듯, 크리스퍼를 이용해 유전병을 치료하려면 최소한 배아 단계에서 유전자를 교정해야 한다. 아직 분화하지 않은 딱 하나의 세포로만 이뤄진 배아 단계에서 유전자를 교정해야 몸속에 서로 다른 유전자(교정된 것과 교정되지 않은 것)가 섞이는 상황을 피할 수 있다.
유전자 조작의 위험성
상당수 과학자는 이 대목에서 고개를 갸우뚱한다. 배아 단계에서 유전병을 진단하는 데는 이미 ‘착상 전 유전 진단’(Preimplantation Genetic Diagnosis·PGD) 같은 유용한 검사 방법이 있기 때문이다. 엄마, 아빠 가계에 유전병이 있는 경우라면 자연임신이 아니라 ‘시험관 아기 시술’ 같은 인공수정이 권장된다. 이 과정을 통해 얻은 배아가 분화를 시작할 때 세포 하나를 떼어내 유전자 검사를 미리 하면 유전병 유무를 확인할 수 있다. 이 검사에서 유전병이 없는 배아만 엄마 자궁에 착상시키면 이후 태어날 아이는 유전병 걱정으로부터 자유롭다.물론 엄마, 아빠 양쪽 다 유전병 유전자를 가진 경우라면 이런 착상 전 유전 진단도 무용지물이다. 이 경우에는 배아 단계에서 크리스퍼를 이용해 유전병의 원인이 되는 유전자를 제거하는 것과 같은 교정만이 해법이다. 하지만 똑같은 유전병을 가진 엄마, 아빠가 만나 아이를 원하는 경우가 얼마나 될까.
과학자들이 크리스퍼 사용을 주저하는 이유는 아직 정확히 어떤 구실을 하는지 모르는 유전자가 매우 많기 때문이다. 인간 생명을 위협하는 암, 심근경색, 당뇨 등의 경우 어떤 유전자가 작용하는지 여전히 오리무중이다. 또 신장, 외모, (좁은 의미의) 지능, 수명 등에 유전이 상당한 영향을 미친다는 사실만 알려졌을 뿐 구체적으로 어떤 유전자가 중요한지는 미지수다. 유전병의 원인으로 지목되는 특정 유전자를 없앴는데, 그 유전자가 몸속에서 다른 긍정적 구실을 할 가능성을 배제할 수 없다. 특정 유전자를 삭제하고 바꿔치기 했다 자칫 예상치 못한 유전적 결함이 발생할 수도 있는 것이다.
대다수 과학자가 ‘맞춤 아기’의 탄생을 아직 할리우드 영화처럼 황당무계하게 여기는 것도 이런 사정 탓이다. 이런 상황에서 섣부르게 유전자를 자르고 붙이는 일은 매우 위험하지 않을까. 그렇게 편집된 유전 정보가 (그 아이가 부작용 없이 자라고 생식 기능을 갖고 있다면) 자손에게 고스란히 전해질 텐데 말이다. 한창 이것저것 만져볼 어린아이가 장난감 권총 대신 실탄이 든 권총을 쥔 상황. 지금 크리스퍼를 손에 쥔 인류 모습이 딱 그런지도 모르겠다.

















